COMBO® Plus
drug eluting stent
コンボプラス
New Generation DES with Additional Value.
New Generation DES with Additional Value.

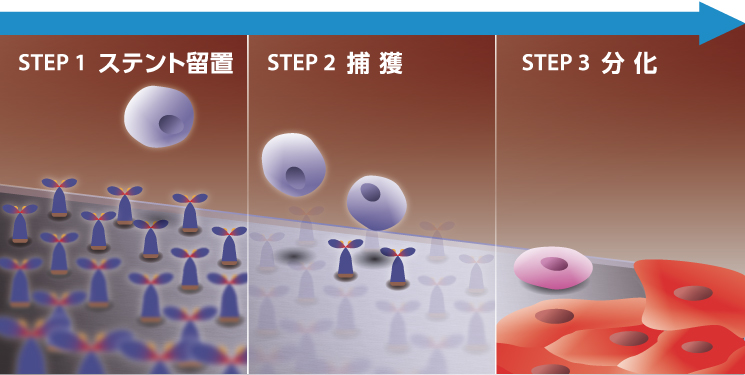
図1.血管内皮前駆細胞(EPC)捕獲イメージ
ステント留置後1年経過時での安全性及び有効性評価において、EESに対し非劣性が認められました。 ※) 図2.図3.参照
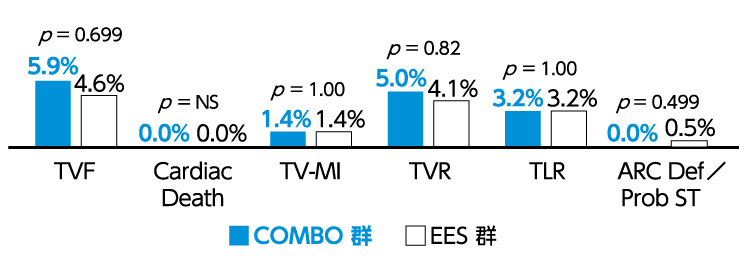
図2.ステント留置後1年経過時までの安全性及び有効性評価項目の発現状況(Japan Cohort)
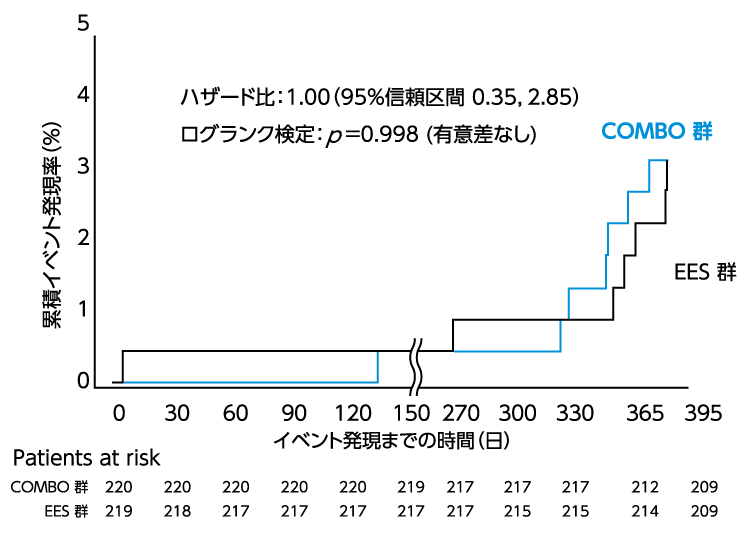
図3.TLR発現率のKaplan-Meier曲線(Japan Cohort)
参照・・・Clinical significance and usefulness of Dual Therapy Stent from the HARMONEE trial:Shigeru Nakamura,CVIT2018
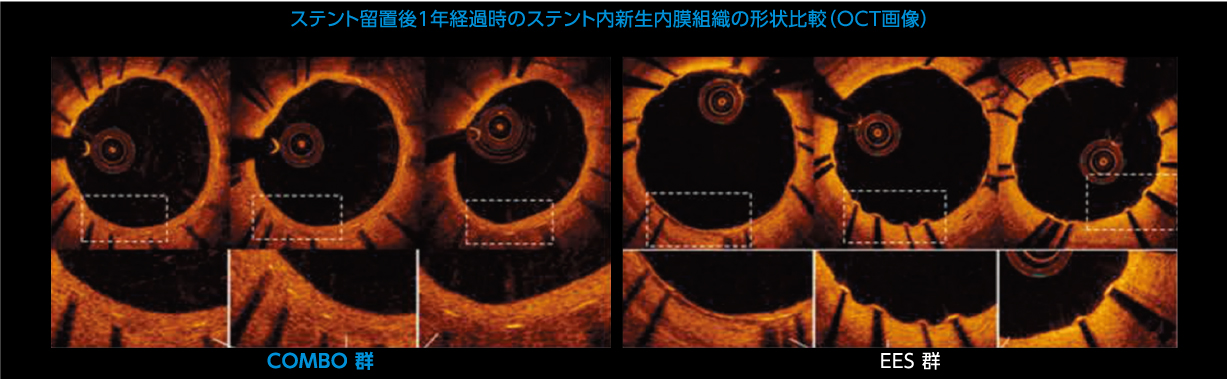
ステント留置後1年経過時でのステント内の健常な新生内膜組織被覆率において、EES群に対し優越性が認められました。 ※)表1.参照
| COMBO群 (N=62) |
EES群 (N=60) |
検定 | |
|---|---|---|---|
| 平均値 (95%信頼区間) |
91.27 (88.71 , 93.84) |
74.82 (70.02 , 79.62) |
ρ < 0.001 |
表1.ステント留置後1年経過時の健常なステント内新生内膜組織の被覆率(%)
参照・・・S.Saito et al.Eur Heart J 2018;39:2460-2468
| 販売名 | COMBO Plus コロナリーステント |
|---|---|
| 承認番号 | 30100BZX00150000 |
| 製造販売元 | オーバスネイチメディカル株式会社 |
| 製造元 | オーバスネイチメディカル社 |
| ステント素材 | ステンレス鋼 316L |
| ストラット厚 | 厚(金属のみ) : 87 μm 厚(金属+ポリマー) : 91 μm |
| 薬剤 | シロリムス |
| ポリマー | 生分解性ポリマー |
| その他のコーティング | 抗CD34抗体 |
| ステント最大拡張径 | 3.25 mm (2.50 , 2.75 mm) 4.50 mm (3.00 , 3.50 mm) |
| カテーテルタイプ | Rapid Exchange |
| バルーン素材/Layer | Nylon |
| Nominal Pressure | 9 atm |
| RBP | 16 atm |
| GCコンパチビリティ | ≧ 5 F |
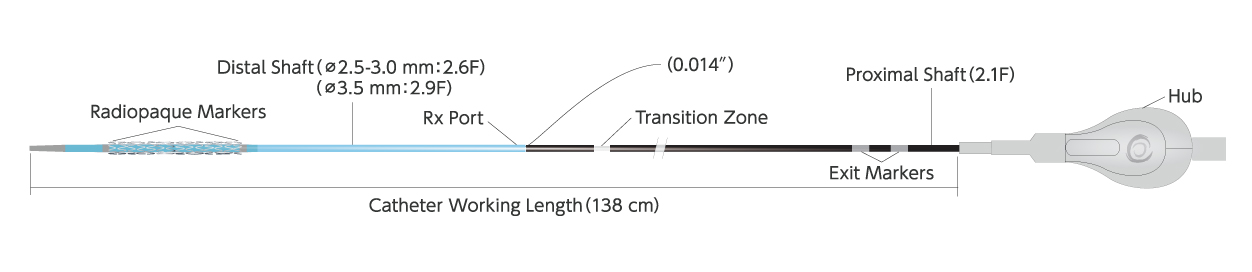
| カテーテル長 | 138 cm |
| コーティング(Distal Shaft) | Hydrophilic |
| Proximal Shaft径 | 2.1 F |
| Distal Shaft径 | Φ2.5 - 3.0 mm : 2.6 F / Φ3.5 mm : 2.9 F |
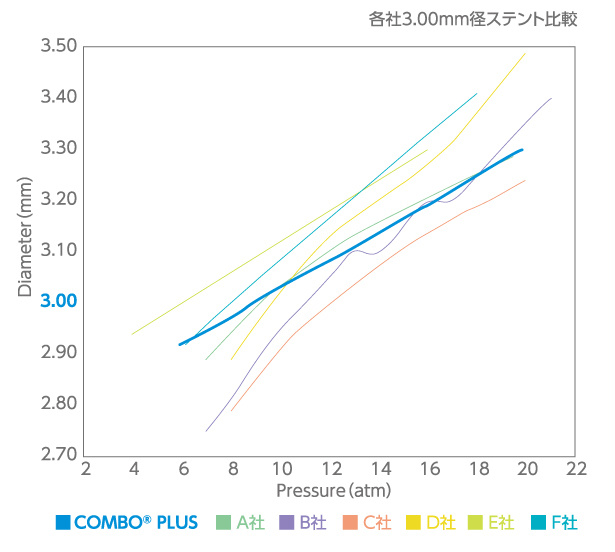
| Pressure(atm) | 2.5 mm | 2.75 mm | 3.0 mm | 3.5 mm |
|---|---|---|---|---|
| 6 | 2.43 | 2.68 | 2.92 | 3.41 |
| 7 | 2.45 | 2.70 | 2.94 | 3.44 |
| 8 | 2.48 | 2.73 | 2.97 | 3.47 |
| 9(NOM) | 2.50 | 2.75 | 3.00 | 3.50 |
| 10 | 2.52 | 2.77 | 3.03 | 3.53 |
| 11 | 2.55 | 2.80 | 3.06 | 3.56 |
| 12 | 2.57 | 2.82 | 3.08 | 3.59 |
| 13 | 2.59 | 2.85 | 3.11 | 3.62 |
| 14 | 2.61 | 2.87 | 3.14 | 3.66 |
| 15 | 2.64 | 2.90 | 3.17 | 3.69 |
| 16(RBP) | 2.66 | 2.92 | 3.19 | 3.72 |
| 17 | 2.68 | 2.94 | 3.22 | 3.75 |
| 18 | 2.70 | 2.97 | 3.25 | 3.78 |
| 19 | 2.73 | 2.99 | 3.28 | 3.81 |
| 20 | 2.75 | 3.02 | 3.30 | 3.84 |
| ステント径 (mm) |
ステント長(mm) | ||||||
|---|---|---|---|---|---|---|---|
| 9 | 13 | 15 | 18 | 23 | 28 | 33 | |
| 2.50 | 225-092-11J | 225-132-11J | 225-152-11J | 225-182-11J | 225-232-11J | ー | ー |
| 2.75 | 227-092-11J | 227-132-11J | 227-152-11J | 227-182-11J | 227-232-11J | ー | ー |
| 3.00 | 230-092-11J | 230-132-11J | 230-152-11J | 230-182-11J | 230-232-11J | 230-282-11J | 230-332-11J |
| 3.50 | 235-092-11J | 235-132-11J | 235-152-11J | 235-182-11J | 235-232-11J | 235-282-11J | 235-332-11J |
| 表紙画像 | 資料名 | 使い方・概要 | 種別 | 印刷仕様 | 入手方法 | 作成年月日 |
|---|---|---|---|---|---|---|
 |
ステント手帳 (COMBO Plus用) |
ステントを留置された患者さんに常 に携帯していただくための資料です。 印刷してお使いください。 |
A4:11枚 A5:22枚 |
リンクをクリッ クするとPDFが 開きます こちらから |
2019年11月 |
弊社製品 COMBO Plus コロナリーステントは、生物由来製品に指定されております。生物由来製品のお取り扱いにあたっては、弊社に医療品医療機器法第 68 条の 22 に基づき、譲渡情報をご提供頂く必要がございます。
弊社は、一般社団法人 日本医療機器ネットワーク協会が運営する「MeBiTS(メビッツ)」という生物由来製品譲渡報告書共同整理システムに参加しております。(複数メーカー参加)
弊社への譲渡報告については、以下のホームページをご覧いただき、新規会員登録の上、本譲渡報告システム(MeBiTS)をご利用いただき、ご報告をお願い致します。
MeBiTSホームページ:https://www.mebits.jp/